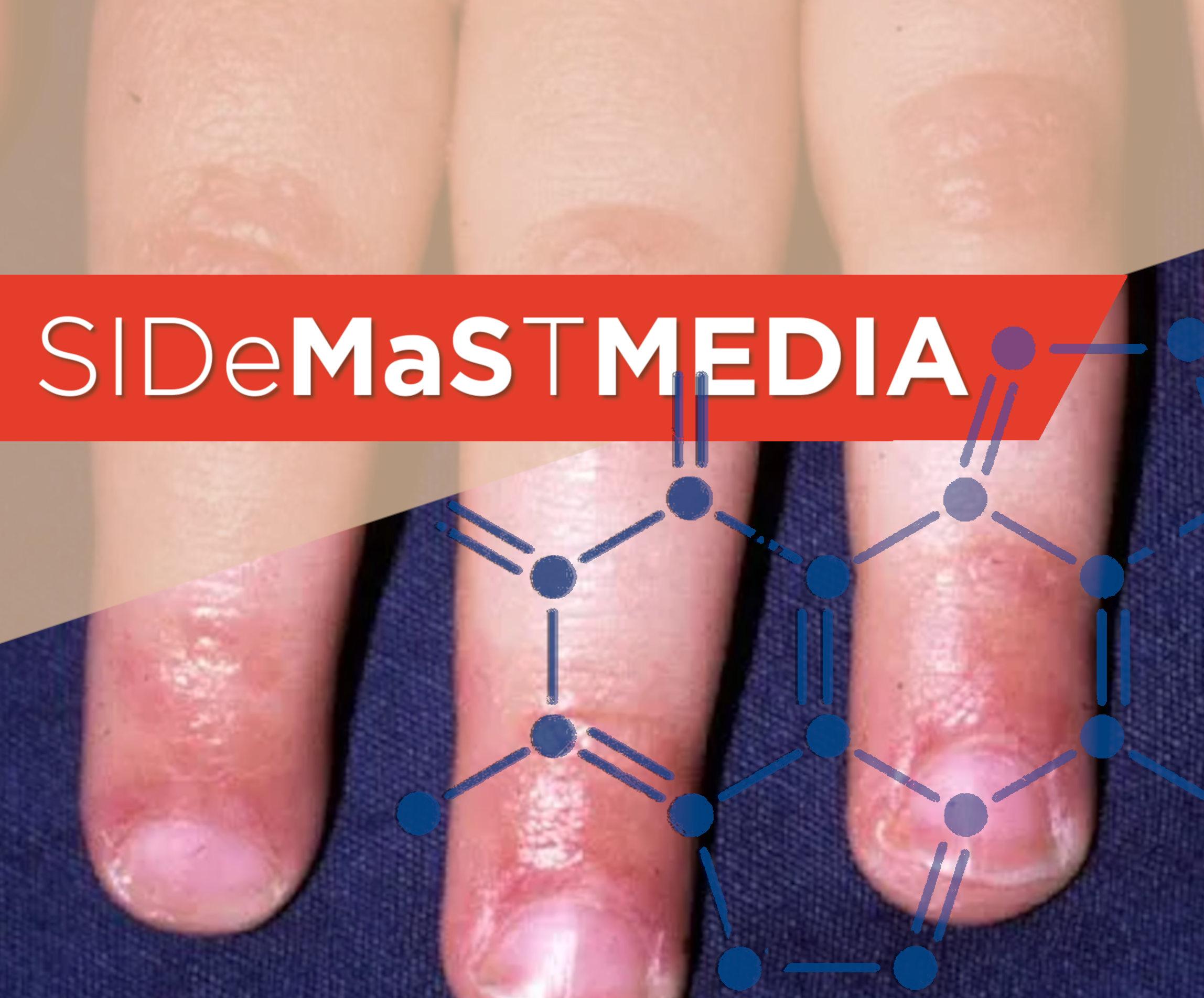
Scorrendo tra i numeri di novembre e dicembre di due tra le riviste scientifiche di riferimento per la dermatologia clinica, il J Am Acad Dermatol ed il JAMA dermatol, vi sono alcuni interessanti aggiornamenti sulla dermatomiosite. In particolare, i lavori pubblicati (e commentati) affrontano una delle problematiche più delicate del management del paziente con dermatomiosite, che, in qualità di clinici, siamo chiamati a gestire non appena abbiamo effettuato questa complicata diagnosi: il rischio di sviluppare complicanze polmonari e quello di insorgenza di una nuova neoplasia.
La dermatomiosite è infatti una patologia eterogenea non solo in termini di manifestazioni cliniche (divise in patognomoniche, caratteristiche e compatibili), ma anche di decorso, prevedendo casi relativamente indolenti ad altri con comportamento biologico più aggressivo e refrattario alle terapie.
L’associazione della dermatomiosite con le neoplasie è ben nota, a tal punto da classificare la patologia tra le dermatosi paraneoplastiche facoltative. La tentazione, da clinico, sarebbe quella di offrire alle nuove diagnosi di dermatomiosite un programma di screening “a tappeto”, allo scopo di individuare precocemente una possibile neoplasia. Tale approccio ha però non pochi svantaggi. Se appare trascurabile l’impatto sui costi, considerando la rarità della patologia, va tenuto conto dei possibili eventi avversi legati ad indagini di imaging come TC con mezzo di contrato e PET, della bassa sensibilità delle indagini sierologiche (es. oncomarcatori) e, non da ultimo, del pathos che genera in un paziente l’attesa di una possibile neoplasia.
Nel lavoro pubblicato da JAMA dermatology, gli autori hanno applicato ad un’ampia casistica di pazienti affetti da dermatomiosite (370), i criteri del “International Myositis Assessment and Clinical Studies Group (IMACS)”, di recente definizione, che si propongono di stratificare i pazienti con miosite (inclusa la dermatomiosite) in tre gruppi di rischio per lo sviluppo di una nuova neoplasia (basso, medio ed alto), offrendo un programma di screening personalizzato a ciascun paziente. Tali categorie sono delineate in base a vari fattori, tra cui l’età, le caratteristiche sierologiche (es. la presenza di anticorpi anti-TIF1γ ed anti-NXP2 definiscono l’alto rischio), alcuni segni clinici (es. necrosi cutanee) ed il decorso clinico (la refrattarietà alle terapie per l’alto rischio).
Mentre per i pazienti a basso rischio viene suggerito uno screening di base non dissimile da quello della popolazione generale stratificata per età e sesso, nei pazienti ad alto rischio il programma prevede il regolare sottoporsi ad indagini di imaging (es. TC e PET). Nello studio pubblicato da Stone e collaboratori, emerge che l’applicazione di questi criteri ai pazienti con dermatomiosite sia stata in grado di cogliere tutti i casi di neoplasia (circa il 5% della casistica) nei tre anni successivi dalla diagnosi, offrendo una sensibilità del 100%. Allo stesso modo, tuttavia, la specificità offerta dai criteri è risultata molto più bassa, ciò significa che questi criteri avevano identificato come ad alto rischio un numero comunque consistente di pazienti (circa il 54%) che tuttavia (e fortunatamente) non avevano sviluppato alcuna neoplasia.
Sono almeno tre le conclusioni da trarre leggendo questo lavoro: la prima, ovvero rassicurare il paziente sul fatto che l’associazione con le neoplasie è comunque bassa (nella maggior parte dei casi il cancro è presente al momento o precede la diagnosi di dermatomiosite); la seconda, perseguire la logica dello “screening a tappeto” si traduce in un inutile spreco di risorse, esponendo i pazienti a potenziali eventi avversi; la terza, proporre criteri diagnostici o di rischio, attraverso una consensus di esperti, necessiterà sempre di una successiva validazione nel contesto di studi clinici, non sempre la real-life rispecchiando fedelmente l’opinione degli esperti.
Nel numero di dicembre del JAAD due articoli invece sono dedicati al rischio di sviluppare complicanze polmonari.
Uno studio retrospettivo ha identificato una correlazione tra un segno clinico poco noto, la presenza di eritema e papule nella regione dell’antelice, con lo sviluppo della patologia polmonare. Il secondo ha messo in evidenza come un altro segno compatibile della dermatomiosite, il fenomeno di Raynaud, sia un fattore di rischio indipendente per lo sviluppo della patologia polmonare, soprattutto se associato alla presenza di anticorpi anti-Ro52, anti-MDA5, e anti-Jo1.
Questi lavori rimarcano quanto l’attenta osservazione clinica ci aiuti non solo nel raggiungere la corretta diagnosi ma ci offra anche spunti utili per predire la prognosi di una patologia e pertanto ottimizzarne la gestione.
La dermatomiosite rimane ad oggi una patologia incurabile. Alcune forme sono particolarmente refrattarie a terapie immunosoppressive maggiori, tra cui si annovera anche l’utilizzo di anticorpi monoclonali anti-CD20. Una nuova prospettiva terapeutica giunge oggi dalla dimostrazione che la dermatomiosite, alla stregua di altre patologie del gruppo delle connettivi (es. lupus eritematoso), sia una dermatosi caratterizzata dalla iperattivazione del pathway degli interferoni di tipo I. Risultati incoraggianti per il trattamento delle manifestazioni cutanee della dermatomiosite refrattaria sono pertanto stati raggiunti da farmaci in grado di bloccare questo driver patogenetico.
Letteratura
1. Maderal AD, Femia A. Clinical Application of New Risk-Based Cancer Screening in Patients With Dermatomyositis. JAMA Dermatol. 2024 Nov 1;160 (11):1151-1152. doi: 10.1001/jamadermatol.2024.3349. PMID: 39320904.
2. Stone CJ, Faden DF, Xie L, Lopes Almeida Gomes L, Hejazi EZ, Werth VP, Shaw KS. Application of Risk-Based Cancer Screening in Patients With Dermatomyositis. JAMA Dermatol. 2024 Nov 1;160(11):1248-1251. doi: 10.1001/jamadermatol.2024.3355. PMID: 39320903; PMCID: PMC11425187.
3. Heymann WR. Refining dermatomyositis. J Am Acad Dermatol. 2024 Dec;91(6):1076-1077. doi: 10.1016/j.jaad.2024.10.003. Epub 2024 Oct 10. PMID: 39393549.
4. Metko D, Bednar D, Legault K, Abu-Hilal M. Prevalence and risk factors of interstitial lung disease in dermatomyositis: A retrospective study. J Am Acad Dermatol. 2024 Dec;91(6):1219-1221. doi: 10.1016/j.jaad.2024.07.1492. Epub 2024 Oct 1. PMID: 39352321.
5. Cheung S, Ye J, Chen S, Ye M, Zhao Q, Zheng J, Cao H. Antihelical erythema/papules as a potential risk factor for acute and subacute interstitial pneumonia in MDA5+ dermatomyositis: A retrospective cohort study. J Am Acad Dermatol. 2024 Dec;91(6):1252-1254. doi: 10.1016/j.jaad.2024.07.1510. Epub 2024 Aug 23. PMID: 39182679.
6. Shaw KS, Hashemi KB, Castillo RL, Rainone E, Ho AW, Kahn PJ, Oza VS, Femia A, Vleugels RA. Anifrolumab in recalcitrant cutaneous dermatomyositis: A multicenter retrospective cohort study. J Am Acad Dermatol. 2024 Dec;91(6):1217-1219. doi: 10.1016/j.jaad.2024.07.1491. Epub 2024 Aug 12. PMID:39142472.